11月18日,中国科学院深圳先进技术研究院陈敬钦、刘成波团队与南方医科大学方驰华团队在国际权威期刊Nature Communications上联合发表题为“Co-delivery of sorafenib and an FSP1 inhibitor triggers dual ferroptosis in tumor cells and immunosuppressive macrophages for enhanced immunotherapy in mouse models of hepatocellular carcinoma”的研究工作。该研究明确FSP1是肝细胞癌中索拉非尼治疗抵抗及免疫抑制微环境形成的关键靶点,并成功构建仿生靶向递送系统。该系统可精准靶向肝癌细胞与免疫抑制性巨噬细胞,通过诱导双重铁死亡实现同步打击,为肝癌联合免疫治疗进而逆转肿瘤免疫抑制,破解晚期肝癌转移复发难题开辟了新的策略。

图1. 文章在线截图。
【研究背景】
肝细胞癌(HCC)是全球范围内导致癌症相关死亡的主要瘤种之一,其高度免疫抑制的肿瘤微环境是导致治疗失败与肿瘤复发的关键因素。在这一微环境中,最富集的免疫细胞类型——肿瘤相关巨噬细胞往往被“驯化”为M2表型,不仅不攻击肿瘤细胞,反而分泌免疫抑制因子,助长肿瘤生长、血管生成与转移,并直接削弱细胞毒性T细胞的功能,导致各类全身治疗反应不佳。索拉非尼作为晚期HCC的标准治疗药物,其重要疗效源于诱导肿瘤细胞发生铁死亡;然而,这反而引起肿瘤细胞上调FSP1等替代通路而产生顽固的治疗抵抗。更为棘手的是,M2型巨噬细胞也被治疗塑造而依赖FSP1来抵御铁死亡,从而在索拉非尼干预后得以幸存并持续发挥免疫抑制作用,形成“治疗后免疫抑制微环境残留”的恶性循环。因此,如何同时克服肿瘤细胞与M2巨噬细胞的双重铁死亡抵抗,并实现药物在两者间的精准递送,或成为摆脱HCC治疗瓶颈、提升免疫疗效的关键突破口。
【研究发现】
本研究首先通过整合多个单细胞测序数据集进行生物信息学分析,确定了铁死亡抑制蛋白FSP1在索拉非尼治疗的肝癌组织中特异性高表达,并与免疫抑制性M2型肿瘤相关巨噬细胞(M2 TAM)的浸润及患者不良预后显著相关。基于此发现,团队创新性地开发了一种基于仿生双靶向铁死亡纳米平台(Sv@PM-M2p)的治疗策略。该平台的精准协同特性主要体现在:1)外包覆的肝癌细胞膜赋予其同源靶向能力,使其能主动识别并富集在肿瘤组织;2)膜表面修饰的M2pep肽段可特异性结合M2 TAM,实现对这两类关键细胞的同步靶向;3)内核采用GSH响应的DS-PLGA聚合物共载索拉非尼与FSP1抑制剂viFSP1,在肿瘤区域高浓度GSH环境下智能释放药物。体内外实验证实,Sv@PM-M2p能高效蓄积于肿瘤部位,并被肝癌细胞与M2 TAM同步摄取。药物释放后,索拉非尼与viFSP1分别抑制GPX4和FSP1两条平行的铁死亡防御通路,协同引发脂质过氧化物的大量累积,最终导致肿瘤细胞与M2 TAM发生双重铁死亡。这一过程不仅直接清除肿瘤细胞,还通过耗竭免疫抑制性的M2 TAM、促进其向抗肿瘤M1表型复极、释放损伤相关分子模式分子激活树突细胞与细胞毒性T细胞,将“冷”肿瘤逆转为“热”肿瘤,重塑了肿瘤免疫微环境。此外,研究进一步揭示,该疗法诱导的干扰素-γ会上调PD-L1,因此联合PD-L1单抗可阻断此适应性耐药通路,进一步激活系统性抗肿瘤免疫,在多种小鼠模型中显著抑制原发性肿瘤生长、远端转移与复发。
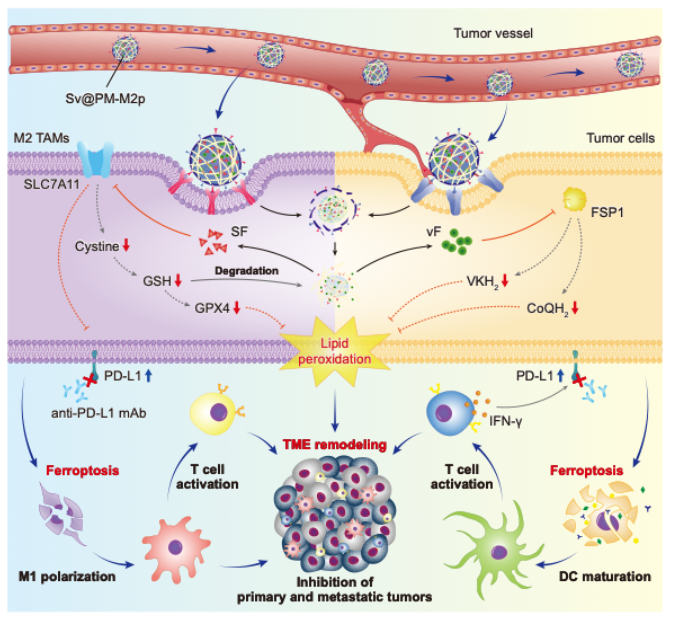
图2. 研究示意图
南方医科大学方驰华教授、中国科学院深圳先进技术研究院陈敬钦副研究员、刘成波研究员为论文通讯作者,南方医科大学博士研究生、中国科学院深圳先进技术研究院客座学生唐传宇为论文第一作者。该研究获得国家重点研发计划、国家自然科学基金委、医学成像科学与技术系统全国重点实验室、中科院青促会、广东省基础与应用基础研究基金委、深圳市科技计划等项目支持。
原文链接:https://www.nature.com/articles/s41467-025-65056-9