4月15日,中国科学院深圳先进技术研究院陈敬钦副研究员、刘成波研究员团队联合深圳理工大学张鹏教授团队在Cell旗下Cell Reports Medicine上联合发表题为“Specific macrophage RhoA targeting CRISPR-Cas9 for mitigating osteoclastogenesis-induced joint damage in inflammatory arthritis”的研究工作。该工作发展了炎症细胞靶向诊疗新技术,实现了类风湿关节炎滑膜巨噬细胞动态示踪与精准调控,阐明了RhoA基因是滑膜巨噬细胞促炎-破骨的关键靶点,为类风湿关节炎等炎症、免疫性疾病的个性化早诊早治提供了新工具,为疾病精准防控带来了新方向。

图1. 文章在线截图。
【研究背景】
类风湿关节炎是一种常见高发的自身炎症性、免疫性疾病,标志性特征为关节滑膜炎,主要表现为:炎症分子的过度表达引起炎症细胞的大量涌入,触发滑膜炎症并导致血管翳形成,进一步侵蚀软骨及骨组织,导致不可逆的关节损伤,中晚期致残率高达60%-70%;更可怕的是,中晚期RA累及关节以外的内脏器官,如肺间质病变和类风湿结节、神经和心血管系统病变等,严重威胁患者身体和心理健康。然而,RA发病机制不明导致早诊早治面临巨大挑战。滑膜巨噬细胞是一把“双刃剑”,它既可以是“破坏者”:促炎、破骨,也可以是“消防员”:抗炎、促进成骨。类风湿关节炎 (RA) 免疫失衡,刺激诱导巨噬细胞向不利角色转化,驱动疾病恶性发展。因此,如何精准阻止或逆转滑膜巨噬细胞的不利转化,是RA诊疗领域的前沿热点课题,由于缺乏对滑膜巨噬细胞特异识别和调控手段,而面临巨大挑战。
【研究发现】
本研究首先通过单细胞数据分析以及基因敲除小鼠模型确定了Ras 同源基因家族成员 A(RhoA)是诱导巨噬细胞破骨细胞生成的关键靶点。基于此发现,本团队首次开发了一种称为特异性巨噬细胞 RhoA 靶向(SMART)的策略,其中富含磷脂酰丝氨酸(PS)的巨噬细胞膜被设计用于递送含有巨噬细胞特异性启动子的 CRISPR-Cas9 质粒(SMART-Cas9)。SMART-Cas9的精准特性主要表现在:1)细胞膜载体可模拟白细胞趋炎作用主动富集在炎症病灶组织;2)外膜修饰PS 的SMART-Cas9释放“吃我”信号,在炎症组织中主动被吞噬从而进入巨噬细胞内;3)巨噬细胞内高表达的CD68主动启动SMART-Cas9中CRISPR-Cas9工作,敲除RhoA基因靶点。多尺度光学成像技术证实了 SMART-Cas9 对发炎关节巨噬细胞的高度特异靶向作用。RA滑膜巨噬细胞RhoA的成功敲除,不仅阻断了巨噬细胞分泌炎症因子,重塑免疫平衡,从源头上降低循环髓样巨噬细胞在关节的聚集,同时通过调控Rho/ROCK信号通路高效影响细胞骨架功能,抑制活化的巨噬细胞向破骨细胞分化,如细胞融合、骨基质降解等。
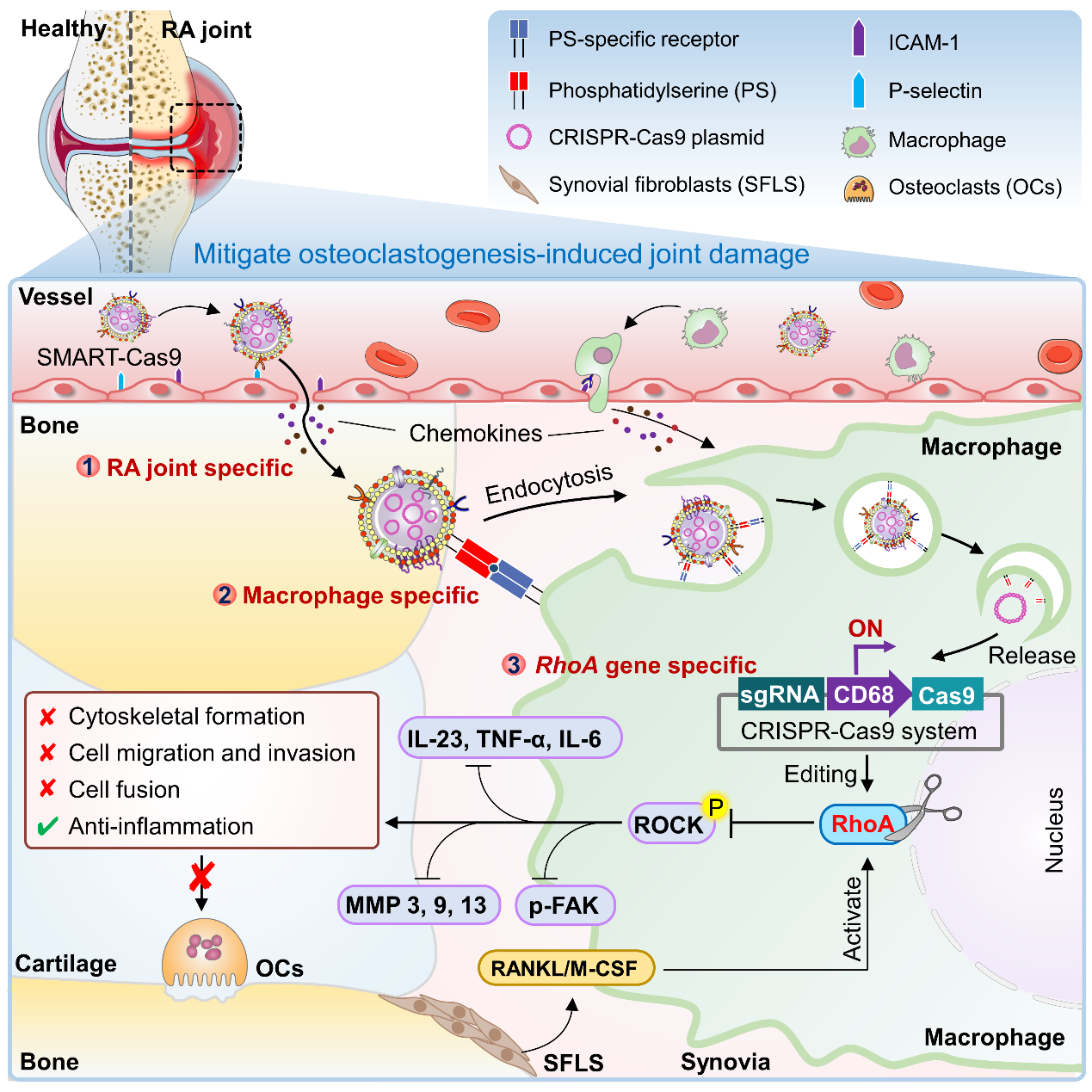
图2. 研究示意图
中国科学院深圳先进技术研究院陈敬钦副研究员、刘成波研究员、深圳理工大学张鹏教授为论文通讯作者,广东医科大学陈建海研究员和中国科学院深圳先进技术研究院硕士生谭键伟为论文共同第一作者。该研究获得国家重点研发计划、国家自然科学基金委、医学成像科学与技术系统全国重点实验室、中科院青促会、广东省基础与应用基础研究基金委、深圳市科技计划等项目支持。同时感谢复旦大学彭勃教授在转基因小鼠模型方面提供的大力帮助,感谢中国科学院深圳先进技术研究院董鹏研究员在数据分析方面给予的大力支持。
【延伸阅读】
研究团队长期聚焦于类风湿关节炎(RA)研究的前沿,通过开发创新光学分子成像技术,实现了对炎症微环境中关键分子、细胞及血管组织的高灵敏度和特异性观测,为重大疾病的精准医疗带来了革新方法和工具。该团队针对RA的重要炎症因子IL-6受体,成功研制了一种IL-6抗体耦合的光声探针。该探针在静脉注射后,能精确映射关节滑膜的炎症程度,与非靶向探针相比,病灶信号特异性显著提升18.6倍,成果已发表于【Advanced Materials, 2020, 32, 2003399】。为了进一步提高炎症分子探测灵敏度和特异性,解决炎症分子低浓度及干扰问题,团队进一步创新,开发了能够突破生物屏障、精准识别炎症标志的仿生光声成像探针,实现了RA早期炎症的全局可视化,如同为医生装上了“炎症分子显微镜”。这项技术通过“趋化-逃逸-识别”的协同机制,开创了智能成像探针设计的新策略,同时可实现类风湿关节炎的确诊时间窗口前移,相关成果已发表于【PNAS, 2022, 119(43), e2213373119】。这一系列研究为RA的早期诊断和精准治疗提供了强大的技术支撑。
文章全文连接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(25)00119-3